임상의뢰자 인력, 비용 등 고려 2021~2022년에는 개발신약 적용
식약처, 9일 환자안전 기반 '임상시험 발전 5개년 종합계획'발표
 |
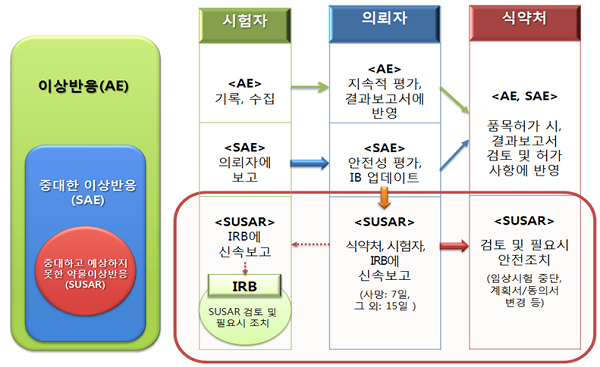
내년부터 중대하고 예상하지 못한 임상시험용의약품의 이상반응(SUSAR) 발생시 임상시험 의뢰자는 이를 종합적으로 평가해 정기적으로 안전성 정보를 보고해야 한다.
다만 임상시험 의뢰자의 인력, 비용 등 사전 준비사항을 고려해 2021~2022년에는 개발신약, 2023년에는 전품목으로 확대 도입된다.
이를 위해 2021년에 임상시험용 의약품의 안전성 정보 평가・관리 가이드라인이 마련될 전망이다.
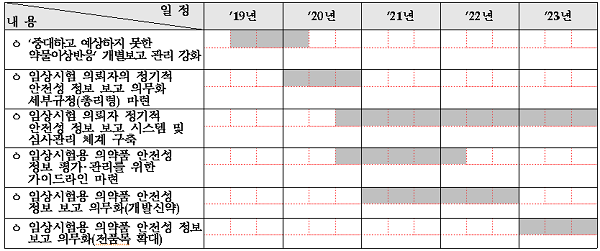
9일 식약처의 임상시험 발전 5개년 종합계획에 따르면 우선 올해부터 중대하고 예상하지 못한 임상시험용의약품의 약물이상반응 발생시 이상반응 개별보고 관리를 강화하고 임상시험 수행 주체인 의뢰자, 실시기관의 이상반응 관리・감독도 추진된다.
이어 내년부터는 임상시험 의뢰자는 임상시험약의 문헌, 관찰연구 등 포함한 모든 안전성 정보를 종합적으로 평가해 정기적으로 보고해야 한다.
다만 임상시험 의뢰자의 사전 준비사항(인력, 비용 등)을 고려해 신약부터 단계적으로 도입키로 했다.
이를 위해 총리령의 정기적 안전성 정보 보고 의무화 세부규정을 마련하는 등 인프라 구축에 나설 계획이다.
세부규정은 보고 대상, 주체, 내용, 시기, 방법 등 구체적 보고 범위 및 절차를 규약하고 DSUR 보고・심사・관리 시스템 구축 및 보고자・심사자를 위한 교육 인프라도 마련한다는 구상이다.
또 2021년부터 임상시험용 의약품의 안전성 정보 평가・관리 가이드라인이 마련되며 안전성 정보에 대한 식약처 심사자를 위한 표준 업무 매뉴얼도 구축된다.
또한 2020~2021년 임상시험 의뢰자의 정기적 안전성 정보 보고 시스템 및 심사관리 체계가 구축되고 임상시험용 의약품 안전성 정보 평가・관리를 위한 가이드라인이 마련된다.
아울러 2021년~2022년에는 개발신약의 임상시험용 의약품 안전성 정보 보고가 의무화되며 2023년에는 임상시험용 의약품 안전성 정보 보고가 전품목 확대된다.
 |
한정렬 기자 jrh05@hanmail.net