수출용 바이오의약품 심사 필요 품목 기준 명확화
혈액성분제제 중 동결혈장 등 76품목 정비안 마련
식약처, '올 바이오의약품 허가 심사 업무 계획' 발표
 |
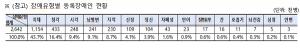
| ▲식약처가 제시한 바이오의약품 규제 관리 선진화 방안 |
식약처가 바이오의약품 허가 심사 기능 강화 차원에서 최초 임상 진입 품목에 대해 임상시험 사전 미팅제 시범사업을 운영한다.
식약처 오일웅 연구관은 지난 19일 식약처 주최로 당산 그랜드컨벤션센터에서 열린 '2019년 바이오의약품 정책.허가심사 설명회'에서 '올 바이오의약품 허가 심사 업무 계획'에 대해 이같이 밝혔다.
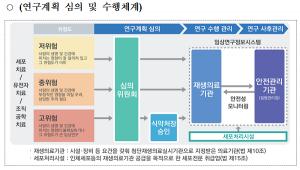
전주기 관리 및 안전사각 지대 관리 강화방안으로 바이오의약품 임상계획 신청 전 개발 경위, 임상시험 실시계획, 자료 제출 요건 등 집중상담을 통해 예비 심사 기능을 강화하는 임상시험 사전 미팅제를 시범 운영할 계획이다.
또 허가심사 규정 개정 및 허가사항 정비에도 나선다.
우선 수출용 바이오의약품 심사 필요 품목애 대한 기준을 명확히 하고 동반진단 의료기기를 사용하는 의약품의 허가사항 기재 근거가 마련된다.
또한 제제별 특성에 맞는 제조방법 작성 요령을 준비하고 자료제출의약품 유형을 구분하고 자료 요건도 정비된다.
이어 바이오시밀러, stand-alone 품목 등 유전자제조합의약품 주성분 명명법의 원칙이 마련되며 혈액성분제제 중 혈장성분군인 동결혈장 등 76품목이 정비안이 마련된다.
식약처는 아울러 하반기에 -제조합의약품의 면역원성 평가에 관한 가이드라인 개정(7월) -생물의약품 제조방법 변경에 따른 비교동증성 평가 가이드라인 개정(11월) -폴리오백신 품질평가 가이드라인 제정(11월) -보툴리늄 독소제제 가이드라인 마련(11월) -면역항암제 임상시험 가이드라인 마련(11월) -세포치료제 품질관리 시험항목 설정 가이드라인 개정(11월) 등 민원인 안내서 제.개정에도 돌입한다.
한정렬 기자 jrh05@hanmail.net