 |
식품의약품안전처(처장 김강립)는 국내 개발 코로나19 백신 SK바이오사이언스 ‘GBP510’ 임상시험을 12월 31일 승인했다고 1일 밝혔다.
현재 국내에서 코로나19 관련해 임상시험을 승인받아 개발을 진행하고 있는 의약품은 치료제 15개 제품(13개 성분), 백신 6개 제품이다.
이번 임상시험은 건강한 성인을 대상으로 ‘GBP510’의 안전성 및 면역원성(바이러스 감염성을 없애거나 낮추는 ‘중화항체’ 증가 비율)을 평가하기 위한 것으로 1상 진행 후 2상을 순차적으로 진행하게 된다.
‘GBP510’은 코로나19 바이러스의 ‘표면항원 단백질’을 유전자 재조합 기술을 이용해 만든 ‘재조합 백신’이다.
 |
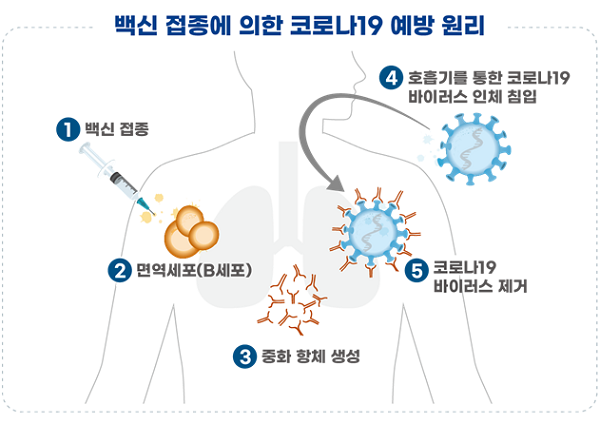
예방원리는 백신의 표면항원 단백질이 면역세포를 자극하여 중화항체를 형성해 면역반응을 유도하며, 코로나19 바이러스가 침입하는 경우 항체가 코로나19 바이러스를 제거하게 된다.
SK바이오사이언스가 11월 23일 임상(1상) 승인받은 재조합백신 ‘NBP2001’는 코로나19 바이러스의 표면 항원 단백질로 면역반응을 유도하고, ‘GBP510’는 표면 항원 단백질이 나노구조(정20면체)를 형성하는 특정 단백질과 결합해 면역반응을 유도하는 차이가 있다.
해외에서도 유전자재조합 기술을 이용한 코로나19 백신의 임상시험이 미국 노바백스社의 3상이 진행되고 있다.
식약처는 "앞으로도 코로나19 치료제·백신 개발에 대한 국민적 관심이 높은 점 등을 고려해 개발 제품의 임상시험 현황에 대한 정보를 신속하게 전달하겠다"며 "안전하고 효과 있는 코로나19 치료제·백신이 신속히 개발될 수 있도록 필요한 사항을 지원해 우리 국민이 치료 기회를 보장받을 수 있도록 최선을 다할 계획"이라고 밝혔다.
 |
한정렬 기자 jrh05@hanmail.net